細胞生物学教室では、ゴルジ体の構造と機能の解明、および細胞の蛋白分泌や極性の形成・維持に重要な極性輸送のメカニズムの解明を目指して、以下のテーマで研究を進めております。
ゴルジ体の構造と機能の解明
ゴルジ体とは?
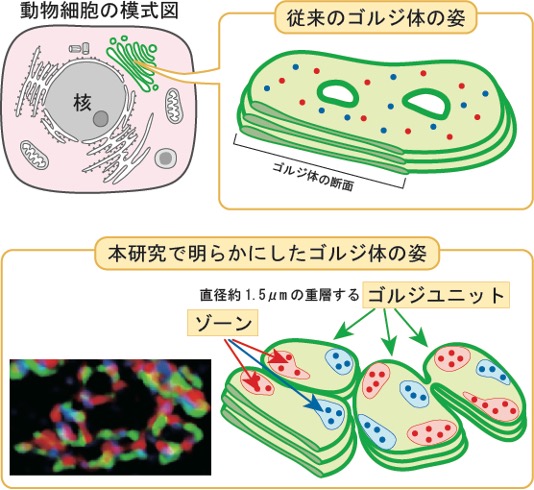
細胞小器官の1つであるゴルジ体は、タンパク質や脂質を修飾し、目的地に分配する機能を持つと考えられている。タンパク質や脂質への修飾には主に糖鎖の付加があり、それが後述する細胞極性にも重要であるが、糖鎖がゴルジ体のどこでどのようにタンパク質や脂質に付加されるか、これまでよくわかっていなかった(上図中の上の模式図)。その理由として主に①それらの糖鎖付加を行う酵素に対する良い抗体がなく、それらの酵素の分布がよくわからなかったこと。②光学顕微鏡の空間解像度が低かったことの2点が挙げられる。
私たちは①で抗体の代わりにCRISPR/Cas9法を用いて標識分子(PA, c-mycなど)を目的の遺伝子に導入することでそれらの酵素の内在性(ありのまま)の局在を可視化することに成功した。更に②で超高解像度の超解像顕微鏡や電子顕微鏡を用いて、微細構造の可視化に成功した。その結果、上図下の模式図のように、ゴルジ体は直径1-3mmの小さな「ゴルジユニット」と呼ぶユニット構造に分かれ、そのユニットが融合や分裂を活発に行うこと、また糖鎖を合成する酵素は5000-15000nm2の面積を持つ塊「ゾーン」となって集まり、それらがゴルジユニットの辺縁近くを動き回ることを明らかにした(下図)(Harada et al., Nat. Comn., 2024)。
今後はゴルジユニットや酵素のゾーンがどのようにして形成されるか、糖鎖修飾を受けるタンパク質はどこを通過して修飾されるのか、などを解明していきたい。

ノックアウトマウスを用いた、細胞の極性輸送のメカニズムの解明
細胞の極性輸送とは?
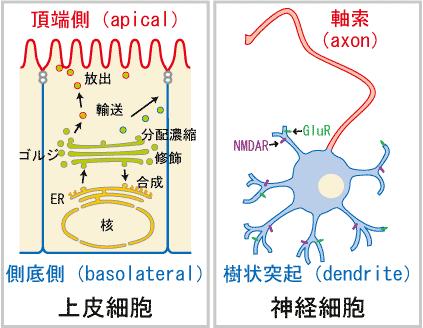
細胞の極性は細胞の機能に重要な役割を果たしている。上皮細胞は頂端側(apical)、側底側(basolateral)という極性を持つことで、分泌などの機能を果たすことができる。同様に神経細胞も軸索、樹状突起という極性のある構造をとることが神経伝達にとって必須である。
このような極性を持つ細胞においては、色々な蛋白が、方向性のある輸送(極性輸送)によって目的地に運ばれてその役割を果たしている。この極性輸送は、
a. ゴルジ装置における輸送小胞への蛋白の分配、濃縮
b. 輸送小胞の目的地への輸送
c. 輸送小胞の細胞膜への繋留、融合
とで成り立っていると考えられている。
細胞の極性輸送のメカニズムを解明するには?
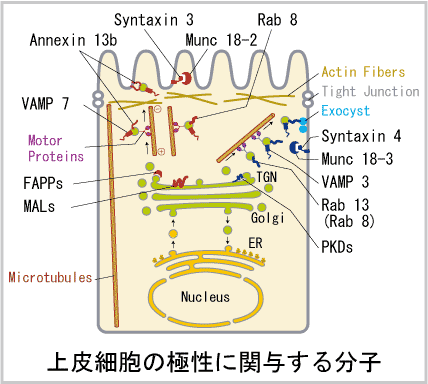
当研究室では、蛋白質の分配や輸送に重要な役割をしていると考えられる蛋白の遺伝子(SNARE蛋白、rab蛋白等)のノックアウトマウスを作成中である。そして作成したマウスを様々な細胞生物学的解析法(共焦点レーザー顕微鏡、電子顕微鏡を用いた形態観察、上皮・神経細胞の単離培養、アデノウイルスベクター等による外来遺伝子の細胞への導入、GFP融合蛋白を用いた生細胞における蛋白輸送の解析等)を用い、遺伝子改変マウス個体・細胞において、極性輸送にどの様な変化が生じるのか、解析を行っている。
更に、このような既存分子の解析だけでなく、細胞の極性輸送に重要な新規分子の同定も行っている。
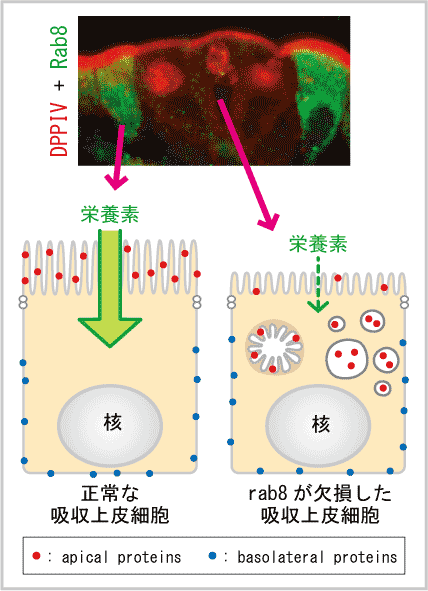
Rab8 ノックアウトマウスの解析で解明されたこと
Rab8 は小腸の吸収上皮細胞に多く発現し、basolateral への蛋白の輸送に必要と考えられていたタンパク質である。Rab8 を欠損するマウスを作製し解析を行ったところ、マウスは生後3~4週間経つと、栄養失調で死亡した。この小腸の細胞では apical に分布する酵素などが細胞内に蓄積した。Rab8 ノックアウトマウスの小腸では栄養の吸収が殆ど見られなかった。これらの症状は、微絨毛萎縮症(小腸から栄養が吸収できない病気のひとつ)の患者さんの症状と非常に良く似ているため、微絨毛萎縮症の患者さんの小腸で Rab8 の量を調べたところ、大幅に減少していることが分った。この研究により、腸における栄養吸収のメカニズムの基盤を解明すると共に、腸からの栄養吸収が低下する病気のモデルマウスを作製することが出来た。このことは将来的にヒトのこの病気の診断治療に結びつく可能性があると共に、栄養吸収を抑える薬剤のターゲットとなる可能性を示した(Sato et al., Nature, 2007)。
その後、我々はRab8の結合分子EHBP1L1を同定し、その欠損マウスを作製した(Nakajo et al., JCB, 2016)。すると大変興味深いことに、EHBP1L1ノックアウトマウスでは赤芽球から核が外に放出されて無核の赤血球が出来る「脱核」という最終段階に異常を来たすこと、横紋筋細胞の核は通常筋細胞の辺縁に局在するが、それが細胞の真ん中に留まることが明らかとなった。さらに、貧血と筋力低下を示すイヌにおいてEHBP1L1遺伝子に突然変異があることが判明した(Wu et al., Blood Adv., 2023)。同様の異常がEHBP1L1に結合するBin1, dynamin2の遺伝子異常によっても生じることから、Rab8/10-EHBP1L1-Bin1-dynaminという流れは、小腸の上皮極性のみならず、赤芽球や筋細胞において核が辺縁に移動する(核の極性移動)ためにも重要であること、つまり広範な種類の細胞の極性形成に重要であることが明らかとなった(下図)。